![[화학] 화합물의 명명법](https://blog.kakaocdn.net/dn/G2TqG/btso11aEDfc/r8OrKcY6XMKxPVnFbJdkd0/img.png)
목차
이온 결합 물질의 명명법
이번에는 이온 결합 화합물과 비금속들이 결합하여 만들어진 공유 결합 화합물의 명명법에 대해 알아보겠습니다.
먼저 1족, 2족과 같은 금속과 15, 16, 17족과 같은 비금속들의 결합에서 만들어지는 이온 결합 화합물의 명명법에 대해 알아보겠습니다.
일반적으로 앞부분의 원소가 플러스, 뒷부분의 원소가 마이너스 원소들을 주로 쓰기 때문에 금속 원소가 M자리에 오고 비금속 원소가 N 자리에 표시됩니다.
M과 N 옆에 소첨자 a, b는 화합물의 전기적인 중성을 맞추기 위해 사용되는 원자의 개수를 의미합니다. 예를 들어 +2인 칼슘이온과 -1인 염화이온은 전체적으로 중성이 될 수 없기 때문에 CaCl2와 같이 소첨자 b 자리에 2를 넣어서 화합물의 중성을 만드는 방법으로 이온 결합 화합물을 표기합니다.
이온 결합 화합물의 이름은 우리말과 영어식 표기에 약간 차이가 있는데, 영어식 명명법은 앞에서부터 뒤로 순서대로 읽으면 됩니다. 앞에 플러스의 원소 이름을 읽고 뒤에 있는 원소는 원소의 이름에 '~ide'를 붙여서 읽습니다. 우리말로 읽게 된다면, 뒤의 원소부터 앞의 원소 순으로 읽는데, 뒤의 원소에 '~화'를 붙여서 읽습니다.
예를 들어 NaCl 같은 경우에는 영어식으로 읽으면 sodium chloride이고, 우리말로 읽으면 염화 소듐이 됩니다. 참고로 예전에는 Na를 나트륨이라고 주로 읽었는데 요즘에는 과학적 표기가 소듐으로 바뀌고 있습니다.

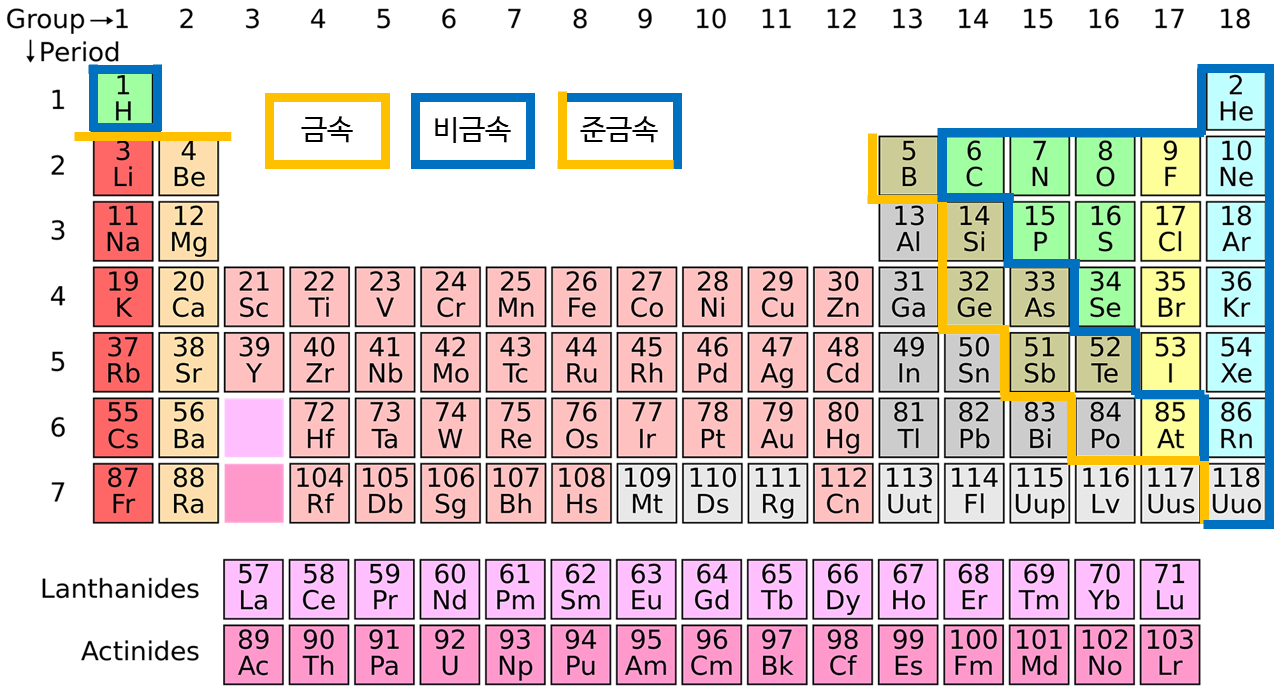
이렇게 각 물질에 이름을 붙일 수 있으며, 일반적으로 주기율표의 왼쪽에 있는 금속 부분은 주로 양이온이 되고 오른쪽에 있는 비금속은 음이온을 형성하는 경향이 있습니다.
주기율표에서 1족은 +1, 2족은 +2, 3족은 대부분 +3의 전하를 가집니다. 17족 또는 7A족이라고 부르는 제일 바깥 껍질에 전자가 7개 있는 할로겐 원소는 -1, 산소나 황처럼 제일 바깥 껍데기에 6개의 전자가 있는 16족 또는 6A족은 -2의 전하를 가집니다.
질소와 같은 15족은 -3의 이온이 되는 경우가 일반적입니다.
공유 결합 화합물의 명명법
성분이 두 가지인 분자성 화합물인 비금속끼리 공유결합해서 만들어진 화합물의 명명법도 크게 다르지 않습니다.
비금속들이 서로 결합하여 만들어지는 화합물의 경우에도 앞의 금속 명명법과 유사하게 이름을 붙입니다. 플러스인 원소를 앞쪽에, 좀 더 마이너스인 원소를 뒤에 씁니다. 이때 주기율표 오른쪽 위에 있는 원소들은 주로 전자를 당기는 걸 좋아하기 때문에 마이너스 원소가 잘 되며, 주기율표 오른쪽 위가 아닌 부분에 있으면 상대적으로 플러스 원소가 잘 됩니다.
이온 결합 화합물의 명명법과 마찬가지로 '~화', '~ide'를 붙어서 읽는 것은 똑같습니다. 다만 이런 분자성 화합물의 경우에는 개수를 나타내야 합니다.

예를 들어, 이산화질소와 산화질소처럼 가끔 다른 비율로 서로 결합하여 다른 종류의 화합물을 만들어내는 경우가 있기 때문입니다. 따라서 수에 관한 접두사를 사용하게 되는데, 영어로 mono (1), di (2), tri (3), tetra (4)로 접두사를 넣어서 이름을 붙입니다.
여기서 두 가지 원소 중 뒤쪽에 있는 원소는 하나가 있든 두 개가 있든 세 개가 있든 꼭 그 개수를 읽어야 합니다.
예를 들어 CO는 일산화일탄소가 아닌 일산화탄소라고 읽습니다. CO2는 이산화일탄소가 아닌 이산화탄소라고 읽습니다. 이렇게 앞에 있는 원소가 하나일 때는 개수를 안 읽어도 됩니다.
[이전 글]
[화학] 주기율표 - 구성과 원소의 특징
2023.07.23 - [Study/공학] - [화학] 화학의 기본 개념 2023.07.24 - [Study/공학] - [화학] 원자와 원소 - 러더퍼드의 실험과 원자 모형 2023.07.25 - [Study/공학] - [화학] 주기율표 - 원소의 특징 목차 주기율표의
curiosity-reports.tistory.com
'Study 차곡차곡 > 공학' 카테고리의 다른 글
| [반도체 기초] 반도체의 발전과 무어의 법칙 (0) | 2023.07.29 |
|---|---|
| [반도체 기초] 반도체란 무엇인가 (1) | 2023.07.27 |
| [화학] 주기율표 - 구성과 원소의 특징 (0) | 2023.07.25 |
| [화학] 원자와 원소 - 러더퍼드의 실험과 원자 모형 (0) | 2023.07.24 |
| [화학] 화학의 기본 개념 (0) | 2023.07.23 |