![[화학] 주기율표 - 원소의 특징](https://blog.kakaocdn.net/dn/5wpBT/btsoypvw3dY/rkM7FxRZLRD674NjFP4b9k/img.png)
2023.07.23 - [Study/공학] - [화학] 화학의 기본 개념
2023.07.24 - [Study/공학] - [화학] 원자와 원소 - 러더퍼드의 실험과 원자 모형
2023.07.25 - [Study/공학] - [화학] 주기율표 - 원소의 특징
목차
주기율표의 소개와 구성
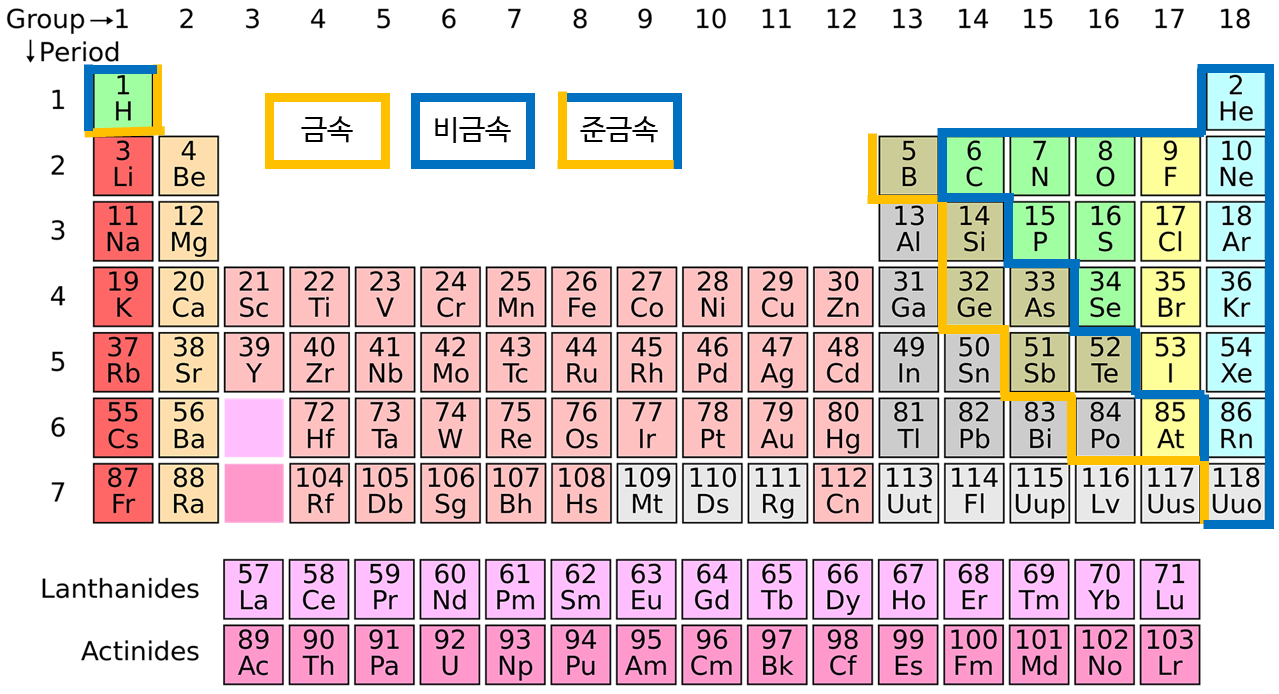
주기율표는 멘델레예프가 1869년도에 고안하여 만들었습니다. 이 주기율표는 원자들이 가지고 있는 원자번호에 따라서 서로 비슷한 특징을 가진 원소들을 같은 그룹으로 묶어서 표현한 것입니다. 여기서 맨 아래 따로 떨어져있는 두 줄은 원래 56번과 72번 원소 사이와 88번과 104번 원소 사이에 들어가 있어야 하는데, 이렇게 하면 표로 그리기 어려워 따로 빼놓았습니다. 원자핵 속에 들어 있는 양성자 수, 원자번호를 따라서 원자의 주기적 성질을 나타낼 수 있습니다. 주기율표에는 각 원소를 원자기호로 표기하며, 보통 원소의 이름에서 첫 번째 알파벳을 대문자로, 두 번째 알파벳을 소문자로 표기합니다. 최근에는 세 글자로 이루어진 원소도 있습니다. 기호는 주로 그리스어나 라틴어의 원소 이름에서 만들어지며, 발견된 지명의 이름에서 만들어지는 원소들도 있습니다.
주기율표는 총 118개의 원소를 나열하고 있습니다. 세로 열을 그룹 또는 족이라고 부르고 가로 열을 주기 또는 피리어드라고 합니다. 세로로 묶인 원소들은 비슷한 화학적 특징을 갖는 그룹이며, 가로로 묶인 원소들은 최외각 전자가 같은 주기에 채워질 때 비슷한 주기를 갖는 원소들입니다.
금속, 비금속, 준금속으로 크게 나눌 수 있는데, 금속은 주로 왼쪽에 위치하며, 비금속은 주로 오른쪽 위 부분에 대각선으로 위치합니다. 금속은 노란색 선이 있는 곳까지고, 비금속은 파란색 부분으로 대각선 쪽에 해당합니다. 준금속은 금속과 비금속의 성질을 모두 가지고 있습니다. 금속은 철 또는 구리, 알루미늄과 같은 일상생활에서 많이 보이는 금속들이 해당됩니다. 비금속은 무른 원소들인데, 일반적으로 산소, 질소, 염소와 같은 기체나 액체로 존재하거나 굉장히 무른 금속들이 속해있습니다. 준금속은 금속과 비금속의 성격을 다 가진 원소로 붕소, 알루미늄 등에 해당되며 활용성이 뛰어나 반도체를 만드는 원료로 많이 사용됩니다.
주기율표에는 많은 원소들이 있지만, 실제로 지구상에서 많이 존재하는 원소는 많지 않습니다. 산소 원자는 지각에서 가장 많이 존재하는 원소로, 산소는 다른 원자들과 결합하여 산화물을 형성하는 등 많은 화학 반응에서 중요한 역할을 합니다. 또한 규소, 알루미늄, 칼슘, 소듐, 포타슘 등이 많이 존재하는 원소로서, 유리나 알루미늄 캔 등 여러 분야에서 활용됩니다.
지각에서 가장 많이 존해하는 산소 원자는 전체의 47%를 차지합니다. 규소는 유리나 투명한 물질을 만드는 재료로 많이 좋재하고 있으며, 알루미늄은 지각에서 8.1% 정도 존재합니다. 칼슘, 소듐, 포타슘 같은 원소도 2.6%, 마그네슘이 2.1% 정도 존재하고 이러한 대부분의 원소를 제외한 나머지 원소들이 0.8%에 해당됩니다.
주기율표의 118개 원소 중에 앞의 8가지 원소를 제외한 나머지 원소가 차지하는 비중이 0.8% 정도 밖에 되지 않습니다.
따라서, 희토류와 귀금속도 지구상에 존재하지만, 그 양이 매우 적습니다. 희토류 원소들은 핸드폰이나 TV등 가전제품에 사용되고 있으며, 귀금속들은 매우 안정적인 화학적 성질을 가지고 있어 변하지않기 때문에 그 가치가 높게 메겨져 있습니다.
옥텟(octet rule) 규칙
주기율표는 지구상에 존재하는 원소들을 각각의 성질에 맞춰서 가로줄과 세로줄로 보기 쉽게 그리고 각 성질을 예측하기 쉽게 만든 표입니다. 원소들은 자기 혼자 있지 않고 다른 물질과 결합하여 새로운 입자인 분자나 이온결합 화합물로 변합니다. 이는 전자 배치라는 개념과 관련 있습니다.
모든 물질을 구성하는 원자는 가운데 조그마한 원자핵과 원자핵을 둘러싸는 넓은 공간에 돌아다니는 전자로 구성된다는 개념은 현재까지 알려진 가장 합리적인 원자 모델입니다. 그리고 제일 바깥 껍질에 있는 전자가 8개가 될 때 원자가 안정화되는 성질이 발견되었습니다. 이를 옥텟 규칙(octet rule)이라고 하며, 화학반응의 기초가 되는 개념입니다. 따라서 어떤 원자든 제일 바깥 껍데기에 있는 전자의 개수를 8개로 맞췄을 때가 가장 안정해지기 때문에, 원자는 자신에게 남은 전자를 버리든 다른 원자에 있는 전자를 빼앗아 가지고 오는 식으로 전자 전달이 이루어지게 됩니다.
주기율표의 특징
이 규칙을 토대로 주기율표에서 주족 원소들을 살펴보겠습니다.
우선 각 주기율표의 세로줄을 족(group)이라고 하며, 같은 화학적인 성질을 가지는 집단입니다. 여기서 수소를 제외하고 수소 밑에 있는 리튬, 나트륨, 소듐, 칼륨, 포타슘 같은 원소들은 1족에 속하며 제일 바깥 껍질의 전자가 1개입니다. 이 경우에는 7개의 전자를 다른 곳에서 얻어와서 8개를 만드는 것보다 하나의 전자를 버려버리는 게 더 수월합니다.
따라서 1족 원소들은 제일 바깥 껍데기의 전자가 1개이므로, 1개를 버리고 양이온이 되는 경향이 있습니다. 2족 원소들은 2개의 전자를 버리고 +2의 이온이 되는 경향이 있습니다.

플루오린, 염소, 브로민, 요오드(아이오딘) 같은 17족 원소들은 제일 바깥 껍데기의 전자가 7개이기 때문에 이 원소들은 전자를 하나 얻어서 -1의 음이온이 되는 경향이 있습니다.
18족 원소들은 0족이라고 부르기도 하는데 헬륨, 네온, 아르곤과 같이 제일 바깥 껍데기가 꽉 채워져 있어 전자를 주거나 받지 않아도 됩니다. 이러한 원자들을 비활성 기체라고 하며, 반응성이 없는 물질이 필요할 때 많이 사용 됩니다.
탄소와 규소와 같은 14족 원소들은 제일 바깥 껍데기에 전자가 4개이기 때문에 4개를 버리거나 가져오기 애매한 원소입니다. 따라서 이러한 옥텟 규칙을 따르지 않으므로 다른 원자들과 전자를 공동 소유하여 새로운 분자를 형성합니다.
주기율표에서 금속은 왼쪽 아래에 위치하며, 최외각 전자는 주로 한 개나 두 개, 세 개의 전자를 가지고 있어 다른 원소들보다 쉽게 전자를 버리는 경향이 있습니다. 전자들이 상대적으로 움직이기 쉬워서 이러한 전자들은 열과 전기를 잘 전달합니다. 금속이 열과 전기를 잘 통하는 이유입니다.
반면에 비금속은 주로 5개, 6개, 7개의 최외각 전자를 갖고 있어 전자를 가지러 가는 경우가 많습니다.
알칼리 금속은 1족에 속하는데, 물에 넣으면 물 위에 떠오르면서 녹기 때문에 알칼리라는 이름이 붙었습니다. 알칼리 금속들은 반응성이 높아서 순수한 홑 원소로 존재하기보다는 다른 물질과 결합한 화합물의 형태로 많이 발견됩니다.
알칼리 토금속은 2족에 속하는데, 알칼리 금속과 비슷한 성질을 가지지만 알칼리 토금속은 지구상에 흔히 존재하는 물질입니다. 이 원소들도 반응성이 높아서 다른 물질과 결합하여 화합물은 형성합니다.
[이전 글]
[화학] 원자와 원소 - 러더퍼드의 실험과 원자 모형
목차 원자 개념의 발전과 원소 원자는 물질의 특성을 가지고 있는 가장 작은 입자입니다. 이러한 원자의 개념은 과거에서부터 계속 발전되어 왔습니다. 예전에는 가장 작은 입자, 더 이상 쪼갤
curiosity-reports.tistory.com
'Study 차곡차곡 > 공학' 카테고리의 다른 글
| [반도체 기초] 반도체란 무엇인가 (1) | 2023.07.27 |
|---|---|
| [화학] 화합물의 명명법 (1) | 2023.07.26 |
| [화학] 원자와 원소 - 러더퍼드의 실험과 원자 모형 (0) | 2023.07.24 |
| [화학] 화학의 기본 개념 (0) | 2023.07.23 |
| [광학 기초] 레이저란 무엇인가? (0) | 2023.06.19 |